
加水分解機能を持つ
人工設計ペプチド
me5f (小さな酵素=
miniature enzyme)
Table of Contents
概要
弊社代表者は神戸大学大学院理学研究科における研究員時代、人工設計ペプチドの研究において、世界で初めて「ペプチド結合(アミド結合)の加水分解を可能にするペプチド」の開発に成功しました。これは、従来のエステル結合加水分解機能を持つ人工ペプチドを独自に発展させた成果であり、ペプチド結合そのものを分解可能なペプチドは、弊社のみが実現している革新的なものです(特許登録済)。
この人工設計ペプチドは、以下のような幅広い分野での応用が期待されています:
- 🧠 医療分野:アルツハイマー型認知症の原因物質とされるβアミロイドオリゴマーの分解による病態改善、ならびに異常タンパク質が関与する各種疾患への応用
- 💄 化粧品分野:角層への低刺激ピーリングや、角栓成分の分解による毛穴洗浄など、肌へのやさしさと機能性を両立した製品開発
- 🥗 健康食品分野:タンパク質の分解補助による消化促進や、腸内環境の改善を目的とした機能性素材としての活用
弊社は、科学的根拠に基づいた分子設計技術を通じて、医療・美容・健康の各分野に新たな価値を提供してまいります。
特許情報
権利種別:登録済み特許
名称:ペプチド結合切断活性を有する人工ペプチドおよびその利用
特許番号:特許7774972
出願人:飯田禎弘
発明者:飯田禎弘、田村厚夫
公開日:2022年10月14日
概要:本発明は、ペプチド結合切断活性を有する人工ペプチド、当該人工ペプチドを含有するペプチド結合切断剤、当該人工ペプチドを含有するアミロイドβタンパク質オリゴマー分解剤、および当該人工ペプチドを含有するアミロイド関連疾患治療用医薬組成物に関するものである。
アルツハイマー型認知症の原因物質とされているβアミロイドタンパク質オリゴマーを分解することができる人工設計ペプチドです。
本ペプチドの特長
- 本人工設計ペプチドは、プロテアーゼ(タンパク質分解酵素)やエステラーゼ(エステル結合分解酵素)に見られる触媒三残基(catalytic triad)の空間配置と構造を模倣しています。
- αヘリックス構造を形成した際に、触媒三残基が適切な位置関係を取るようにアミノ酸配列を精密に設計しています。
- わずか14残基という短鎖ペプチドでありながら、加水分解機能を発現するよう設計されており、構造と機能の両立を実現しています。
- 加水分解反応は、ペプチド内部に配置された触媒三残基(His, Ser, Asp:ヒスチジン、セリン、アスパラギン酸)や、触媒二残基(catalytic diad)であるHis, Aspによる電子の授受を通じて誘導されます。
- 通常はランダムコイル構造をとるものの、分子夾雑環境下ではαヘリックス構造を形成することが推測され、その際に加水分解活性が顕在化します。
- 標的タンパク質との結合により誘導適合(induced fit)を起こし、最適な立体構造へと変化することで、ペプチド結合の加水分解機能を発現します。
- βアミロイドオリゴマーの分解に関する実験データおよびペプチド結合(アミド結合)の加水分解に関する根拠データを取得済みであり、機能性の科学的裏付けがあります。
- 従来医薬品と標的分子に対するアプローチや作用点が異なります。(下記図参照)
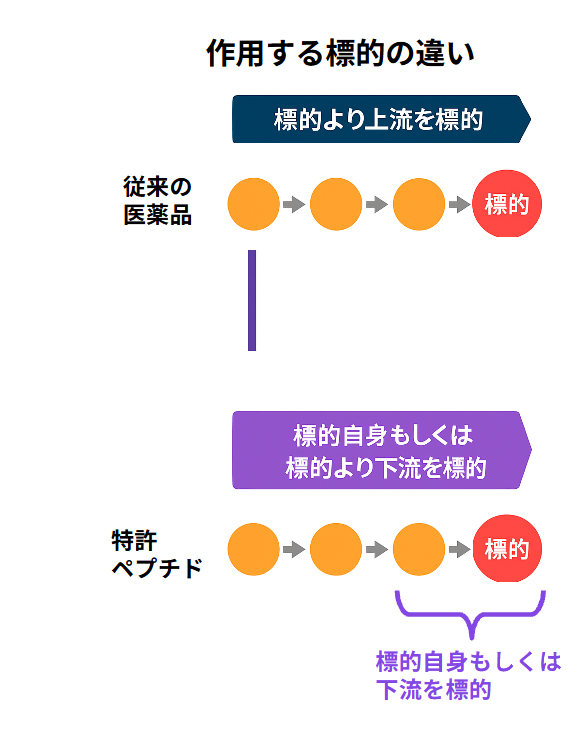
従来薬は標的より上流を狙うのに対し、
特許ペプチドは標的自身またはその直上流に作用する。
従来の医薬品は、疾患の原因となる標的分子の上流に位置するシグナル伝達経路や調節因子を阻害することで、間接的に病態を制御します。一方、弊社が開発した特許ペプチドは、標的分子そのもの、あるいはその直上流に直接作用するよう設計されており、より低刺激かつ効率的な機能制御が可能です。この図は、両者の作用点の違いを視覚的に示したものです。
応用分野・用途例
🧠 医療分野
- 🧠神経変性疾患:
アルツハイマー病におけるβアミロイドオリゴマーやTauタンパク質、パーキンソン病に関与するα-シヌクレインなど、異常凝集したタンパク質の分解により、神経毒性の軽減と病態改善が期待されます。 - 🧬がん領域:
慢性骨髄性白血病の原因であるBCR-ABL融合タンパク質や、KRAS変異型、変異型p53などの“アンドラッガブル”な腫瘍ドライバータンパク質に対して、分解誘導による機能抑制が可能です。これにより、細胞増殖の制御や治療抵抗性の克服が期待されます。 - 🛡自己免疫・炎症性疾患:
関節リウマチや炎症性腸疾患(IBD)などにおいて、TNF-αやIL-6などの炎症性サイトカインを分解することで、過剰な免疫反応を抑制し、症状の緩和に寄与します。
💄 化粧品分野
- 🌿低刺激ピーリング:
角層に存在するケラチンタンパク質のペプチド結合を穏やかに分解することで、物理的刺激や酸性成分に頼らない低刺激ピーリングが可能です。敏感肌や加齢肌にも適した角質ケアを実現します。 - 🔬毛穴洗浄・角栓分解:
毛穴に詰まった角栓は、皮脂とタンパク質が混合して形成されます。人工ペプチドがタンパク質成分を分解することで、角栓の除去を促進し、毛穴の清浄化と肌の透明感向上に寄与します。 - 💧肌環境の整備とターンオーバー促進:
古い角質やタンパク質残渣を分解することで、肌のターンオーバーを自然な形で促進し、くすみやざらつきの改善に貢献します。 - 🧪機能性化粧品への応用:
加水分解機能を持つペプチドを美容液・洗顔料・パックなどに配合することで、従来の酵素系成分とは異なる作用機序を持つ高機能製品の開発が可能です。
🥗 健康食品分野
- 🍽タンパク質の消化補助:
食事由来のタンパク質は、消化酵素によって分解されますが、加齢や消化機能の低下により分解効率が落ちることがあります。人工ペプチドがペプチド結合を直接加水分解することで、消化を補助し、栄養吸収効率の向上に寄与します。 - 🦠腸内環境の改善:
腸内に残留する未消化タンパク質は、悪玉菌の増殖や腸内腐敗の原因となることがあります。人工ペプチドが未消化タンパク質を分解することで、腸内フローラのバランス改善や腸管の健全化を促進します。 - 🧪機能性素材としての展開:
加水分解機能を持つペプチドをサプリメントや機能性飲料に配合することで、消化・吸収・腸内環境に働きかける新しい健康食品素材としての展開が可能です。 - 🛡免疫・代謝への波及効果:
腸内環境の改善は、免疫機能や代謝バランスにも影響を与えることが知られており、全身の健康維持をサポートする素材としての可能性も広がります。
構造モデル・図解
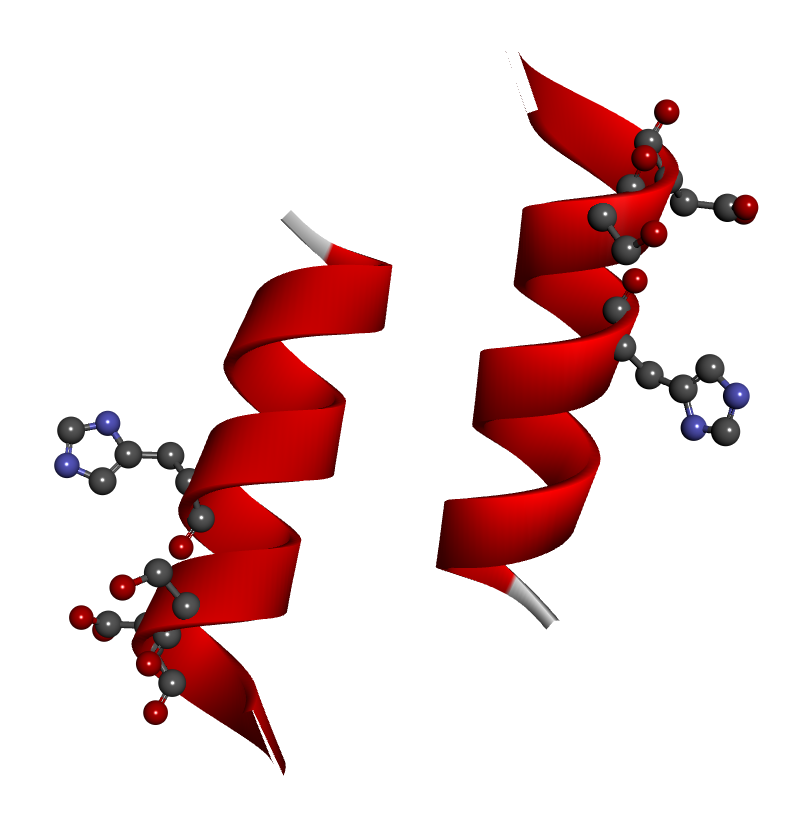
本ペプチドは、触媒残基の配置を最適化することで、標的分子に対する加水分解反応を実現しています。
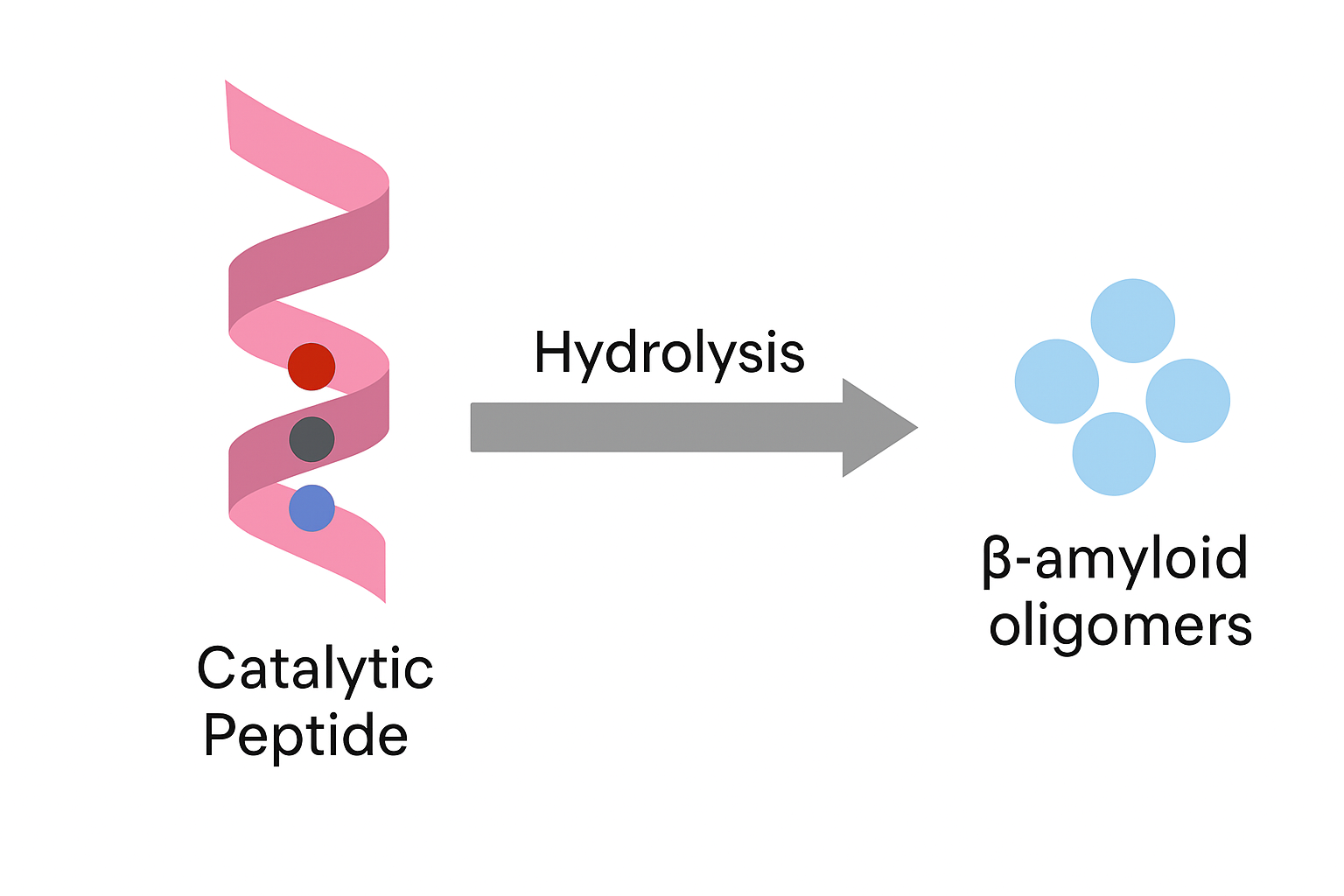
本図は、人工設計ペプチドがαヘリックス構造を基盤とし、触媒残基(His、Ser、Asp)を介してβアミロイドオリゴマーに選択的に作用する様子を示しています。電子授受によって加水分解が誘導され、神経変性疾患の原因物質に対する分解活性を発揮する設計となっています。
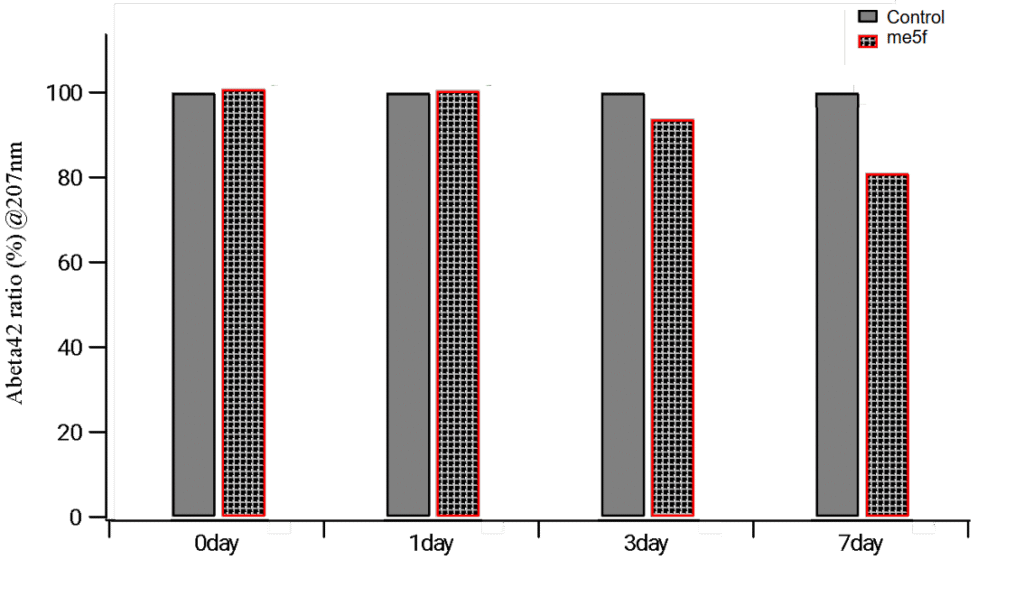
測定条件(βアミロイドタンパク質濃度:1μM、ペプチド濃度:10μM、37℃、pH7.2のPBS下で反応)
本図は、βアミロイドオリゴマーに対するme5f処理の影響を、207nmでのUV吸収測定によって定量したAbeta42残存比率で評価した結果を示しています。Controlサンプルを100%と基準化し、me5f処理による経時変化を割合で表示しています。me5f群では7日目にかけて経時的に有意な減少が認められ、構造変化を伴う分解が進行している可能性が示唆されます。これは、人工設計ペプチドme5fがβアミロイドオリゴマーに選択的に作用し、加水分解を誘導する機能を持つことを裏付ける結果です。
[特許文献:特開2022-158028より引用]
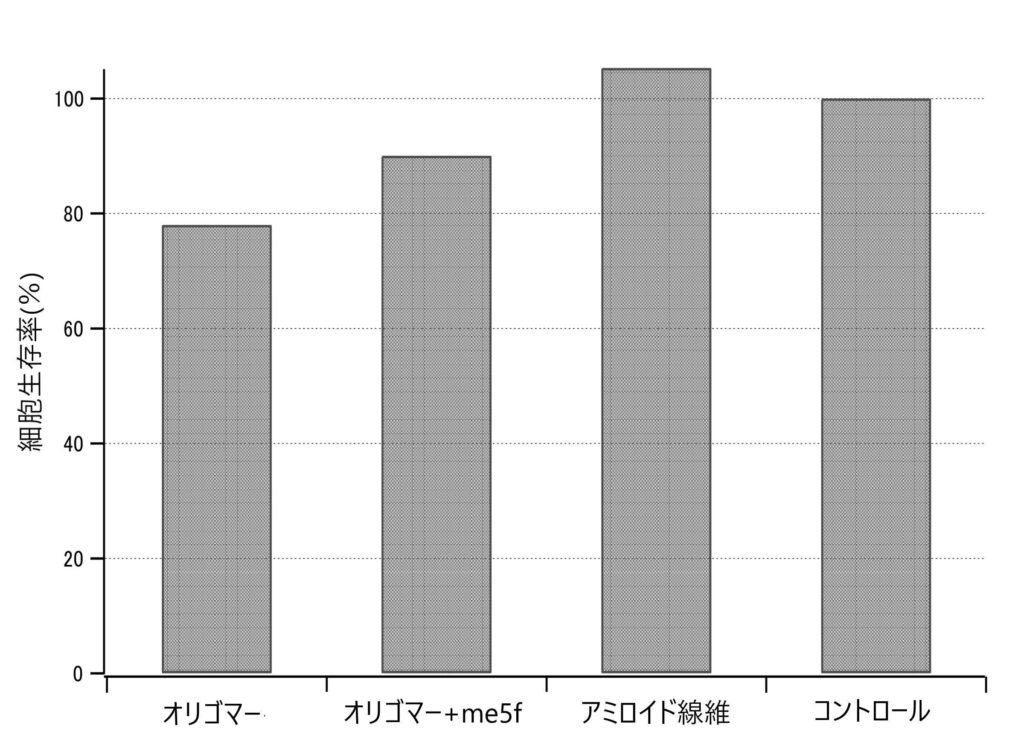
本図は、βアミロイドオリゴマーの細胞毒性を評価するために実施した細胞生存率試験の結果を示しています。オリゴマー単独では細胞生存率が著しく低下する一方、me5fを共存させた条件では生存率が有意に改善されました。これは、人工設計ペプチドme5fがβアミロイドオリゴマーの毒性を緩和する機能を有することを示唆しており、神経細胞保護への応用可能性を裏付ける結果です。アミロイド線維やコントロール群との比較により、毒性の段階的差異も明確に示されています。
研究開発ストーリー
- ① 開発のきっかけ
近年、医薬品・化粧品・健康食品などの分野では、ペプチドを含む多様なモダリティや膨大な種類の分子が活用されています。しかし、それらの多くは、体内の分子との結合を介して生体シグナルを伝達する「間接的な作用」に依存しており、副作用の発現や作用効率の低さが課題となっていました。
私はこの課題に対し、「直接的な分子作用」によって効率性を飛躍的に高めるアプローチを模索しました。まず、肥満症や生活習慣病に深く関与する脂肪細胞内の脂質分子を、選択的かつ直接的に分解する人工設計ペプチドを開発。さらに応用を広げ、脳内に蓄積するβアミロイドオリゴマーを分子結合レベルで分解するペプチドを設計することで、アルツハイマー型認知症に対する高効率な治療法の可能性を追求しています。 - ② 技術的挑戦
これまで誰も実現できなかった「特定タンパク質の加水分解を可能にするペプチド」の人工設計には、単なる構造安定性や触媒三残基の配置だけでは不十分でした。
分子の柔軟性・構造揺らぎ・構造指向性といった、流体力学・熱力学・エネルギー論的な視点を統合的に考慮する必要がありました。これらの要素を踏まえ、分子モデリングと実験評価を幾度となく繰り返し、最適なアミノ酸配列に到達するまでに数年を要しました。 - ③ ブレイクスルー
本ペプチドの人工設計では、αヘリックス構造に触媒三残基を適切に配置した独自の脂肪分解ペプチドを基盤とし、あえて構造安定性に寄与する部分を削除することで、加水分解反応性を保持しながら、分子の柔軟性・構造揺らぎ・構造指向性を新たに取り入れました。
その結果、10nm〜数十nm規模の分子や分子会合体に選択的に結合し、最適な立体構造を形成した際にペプチド結合を分解する能力を発揮。特に、βアミロイドオリゴマーに対しては高い分解活性を示し、アルツハイマー型認知症への応用可能性が示唆されました。
この成果は特許査定を受け、技術的独自性と革新性が正式に認められています。 - ④ 応用可能性
本特許ペプチドは、標的分子に選択的に結合し、必要な場面で加水分解活性を発揮する「小さな酵素」として機能します。従来のタンパク質酵素や抗体では困難だった作用機序や反応を、コンパクトな分子設計によって実現できる点が大きな特長です。
この新規機能性により、脂肪細胞内の脂質分解や、βアミロイドオリゴマーの分解による認知症治療など、医療・化粧品・健康食品分野への応用が期待されます。今後は、標的分子の多様化やドラッグデリバリー技術との融合を通じて、より高精度かつ低副作用な次世代モダリティの創出を目指します。 - ⑤ 研究者の声
「ペプチド分子設計は、科学的知見と直感的な閃きの融合だと私は考えています。これまでに蓄積された知識と、構造や機能を思い描く想像力を掛け合わせることで、人類を次のステージへ導く“分子の魔法”を創れるのです。
本ペプチドは、機能の合理性を徹底的に追求した結果、科学の本質とも言える「シンプルさ」を体現する構造にたどり着きました。その洗練された設計は、複雑さを排した美しさを備えており、分子レベルでの機能美を感じさせる作品となっています。
単なる技術成果にとどまらず、「シンプルな反応機構と機能作用」によって生命化学の新たな可能性を切り拓く存在です。医療や日常生活の中で、より自然で効率的な分子作用が実現される未来を目指し、今後も探究を続けてまいります。」(開発責任者・飯田禎弘)
お問い合わせ
ご興味がありましたらお気軽にお問い合わせください。